Je me permet d’infirmer a l’aide d’une photo:

a droite, une broche en inox 304, pas de traces blanches,
a gauche, un goujon zingué enfoncé au marteau (donc plus « d’abris »), et une belle trainée blanche en dessous.
pour la science, ca vaudrait le coup que j’enfonce un peu plus loin ce goujon, mette une larme de sika pour « patcher », et regarde combien de temps ca met a se regriser…
Coulées blanches sous les spits/goujons
L’oxydation du zinc en présence d’eau et de dioxyde de carbone donne lieu à une réaction chimique qui forme le carbonate basique de zinc avec entre autre des ions hydronium . Ceux-ci sont solubles dans l’eau et de ce fait l’eau qui s’écoule sous les broches ou plaquettes a un caractère acide et blanchit les roches calcaires.
Ok il attaque le calcaire mais pourquoi ça le blanchit ? Ça doit enlever la couche superficielle grise due à quoi je sais pas… (poussière pollution lichen les 3 à la fois autre)
la réponse à cette question est déjà dans le fil …
Valable ou pas est une autre question que je serais bien incapable de trancher mais c’était convaincant
Micro-lichens
j’ai toujours pas compris, si le carbonate de zinc est basique alors l’eau qui coule dessus se basifie, et sa teneur en protons H+ sera très faible, tu peux pas avoir des protons issus d’une base puisqu’elle va les capter. Et le carbonate de zinc est soluble en milieu acide.
Ben le mieux c’est de coller un thésard là-dessus (au Sika).
Plus que pour la science, tu pourrais le faire pour la beauté de la falaise 
Quelques précisions sur le caractère acide des eaux de ruissèlement sous les plaquettes ou broches zinguées.
Le carbonate basique de zinc de formule 2ZnCO3,3Zn(OH)2 se forme en plusieurs étapes à la surface du métal, en présence d’eau, de dioxyde de carbone et d’oxygène.
La première étape est la formation d’oxyde de zinc ZnO à partir du zinc, de l’eau et de l’oxygène suivant une réaction d’oxydo-réduction comme décrite dans le schéma .
La seconde étape est la carbonatation de l’oxyde de zinc. Le dioxyde de carbone dissout dans l’eau conduit à 2 équilibres chimiques : (écrits de manière simplifiée sur le schéma)
CO2 + 2H2O === HCO3- + H3O+ (ion hydrogènocarbonate et ion hydronium)
Puis HCO3- + 2HO3+ === CO32- + H3O+ (ion carbonate)
Selon les conditions expérimentales (température, concentration en CO2 … ) ces équilibres sont plus ou moins déplacés vers la droite ou la gauche.
L’oxyde de zinc, formé à la surface du métal, va réagir avec les ions carbonate et hydrogènocarbonate et former le carbonate basique de zinc. Cette espèce adhère au métal par des phénomènes d’adsorption très fort et ainsi le protège.
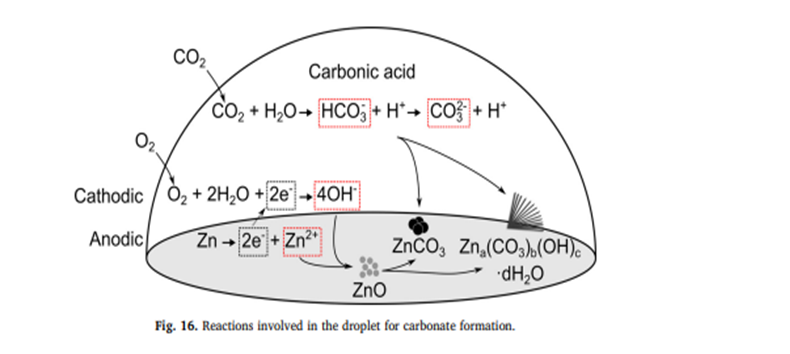
Les ions hydronium issus des équilibres de la réaction du CO2 et de l’eau ne sont pas consommés . Ils sont responsables de l’acidité de l’eau qui va s’écouler sous la plaquette, le pH étant de l’ordre de3 ou 4. Ils n’ont pas d’action sur le carbonate basique de zinc qui peut être attaqué par un acide mais avec une concentration beaucoup plus élevée.
L’eau de ruissèlement acide aura une action sur les mousses et lichens et sur la roche calcaire en provoquant une attaque très superficielle, les ions hydronium sont en faible quantité mais le processus se renouvelle à chaque pluie !! Le calcaire retrouve sa couleur d’origine.
Complément d’information sur Formation of corrosion products on zinc in wet supercritical and subcritical CO2: In-situ spectroscopic study (archives-ouvertes.fr) (10 pages en anglais)
Milles mercis, je vais copier cette explication scientifique, qui démontre si bien ces coulures blanche, et maintenant je sais le pourquoi du comment… 
Il y a un truc bizarre :
Ils sortent d’où les ions HO3+ ?
A moins que ce soit une faute de frappe, et que c’est H3O+.
Auquel cas, pourquoi ne pas simplifier l’équation en :
HCO3- + H2O <==> CO32- + H3O+
Si on fait le bilan, pour avoir 1 ion carbonate :
CO2 + 3·H2O <==> CO32- + 2·H3O+
Pourtant il y a production de 4·OH- pour chaque carbonate consommé, donc production de 2·OH- pour chaque H3O+ produit.
D’habitude, H3O+ aime bien se neutraliser avec OH-, surtout si OH- a une concentration double de celle de H3O+ ?
(Mais peut être que OH- préfère fricoter avec ZnCO3, laissant les H3O+ sans surveillance, qui en profitent pour couler sous le point et bouffer du lichen.)
Punaise, ce fil est FABULEUX !
On croit voir un point gagnant et PAF ! reprise de volée et le match est relancé …
Quel suspens !
de fait : il y a des fautes de frappes dans les coins … et les équations du schéma ne sont pas toutes équilibrées…
mais sur le fond : l’explication de laurentmm laisse à entendre que c’est l’acidité de l’eau qui a un effet sur la matière vivante présente sur la roche (biofilm, mousses, lichens ,… grimpeurs ?)
or, à mon humble avis, c’est le fait que cette eau légèrement acide a préalablement dissous du Zn au niveaux des ancrages galvanisés (effectivement, probablement sous forme d’hydrogéno-carbonate) qui la rend toxique.
Parce que l’eau de pluie est quasi toujours un peu acide (comme expliqué : à cause du CO2 atmosphérique) !